伟德源自英国始于19462009届校友崔北米、2010届校友潘巧娜共同在Science Advances上发表研究论文
【转自Ad植物微生物公众号】英国爱丁堡大学与贵州大学刘凤权团队在Science子刊Science Advances杂志在线发表了题为“S-nitrosylation of a receptor-like cytoplasmic kinase regulates plant immunity”的研究论文,揭示了信号物质一氧化氮(NO)调控植物细胞抵抗微生物入侵的防御新机制。该研究系统分析了植物PTI中产生的NO通过亚硝基化修饰,进而调控核心蛋白BIK1的蛋白激酶活性,磷酸化水平以及与RBOHD互作来调控植物PTI机制。该研究不仅发现了依赖于氧化还原介导的蛋白质翻译后修饰BIK1来调控PTI,而且还阐明了PTI中新的信号分子NO,解答了1998年Nature论文中NO作为免疫信号物质的分子机制,完善了PTI信号转导网络。

细胞氧化还原状态的变化是真核生物免疫信号级联反应中的一个显著特征。在植物中,识别病原体/微生物相关分子模式(P/MAMPs),细菌鞭毛受体(FLS2),EF-Tu受体(EFR)等,通过膜定位的模式识别受体(PRRs)FLS2和EFR,分别引发P/MAMP诱导的免疫(PTI)。FLS2和EFR都与受体激酶(receptor-like cytoplasmic kinase)相互作用,这对于下游信号传导至关重要。例如,受体激酶BIK1该激酶在PRR识别PAMP后被激活并触发一系列下游免疫反应,特别是与NADPH氧化酶RBOHD互作并激活其活性,进而诱导ROS的迸发。虽然1998年报道NO参与植物免疫反应,而且PTI反应中也会促发NO的产生,但是目前有关NO参与PTI的机制还不清楚。
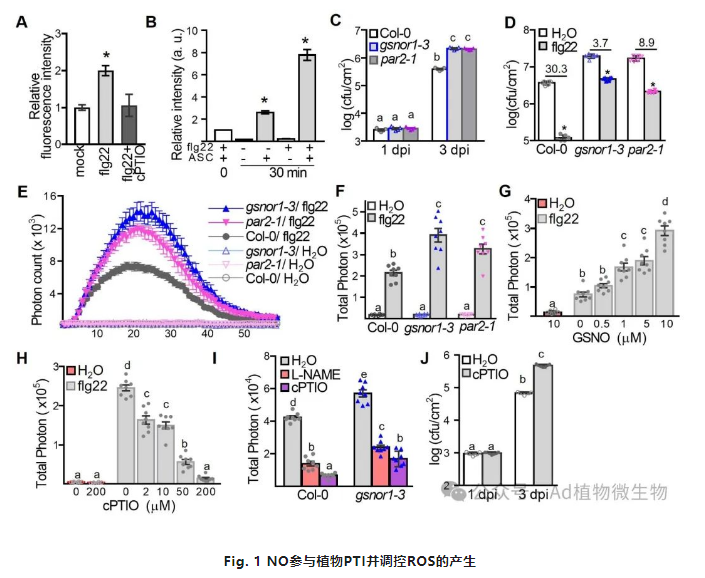
为了分析NO在PTI中可能发挥的作用机制,作者首先研究了拟南芥在PAMP分子flg22处理后检测到了NO的迅速爆发。然而,利用NO清除剂cPTIO和NO合成抑制剂L-NAME可消除flg22诱导的NO产生,说明NO可能在PTI中起着重要作用。NO主要通过蛋白质的亚硝基化修饰(SNO)来调控信号转导。作者利用检测蛋白质亚硝基化修饰的实验技术,生物素转化实验室试验(biotin-switch assay,BST)来验证PAMP诱发的NO是否会引起细胞内总蛋白的亚硝基化修饰,结果显示,在flg22处理后,总蛋白质S-硝基化显著增加。
植物细胞中NO主要以S-硝基谷胱甘肽(GSNO)形式存在,而且GSNO受S-硝基谷胱甘肽还原酶1(GSNOR1)的调控,例如拟南芥GSNOR1的突变体gsnor1-3中GSNO和蛋白质亚硝基化(SNO)水平都很高。因此,为了评估NO在PTI中的功能,作者对GSNOR1功能缺失突变体gsnor1-3进行了测试,发现gsnor1-3对Pst DC3000的抗性受到了抑制。另外作者还发现flg22诱导对Pst DC3000的抗性在突变体gsnor1-3中减弱。为了确定这一现象的分子基础,作者检查了PTI相关的反应,包括FRK1的表达,胼胝质沉积(callose deposition)和ROS的产生。相比野生型Col-0植物,FRK1和callose deposition在gsnor1-3突变体中均减少了。令人意想不到的是,flg22触发的ROS产生在gsnor1-3中显著增强。为了进一步评估NO在P/MAMP触发的ROS爆发中的作用。利用NO超标达突变体nox1,以及NO抑制剂,NO供体等处理均发现在PTI响应中NO可明显增强ROS的产生。这些结果表明在PTI过程中,NO是ROS产生的关键调节因子。
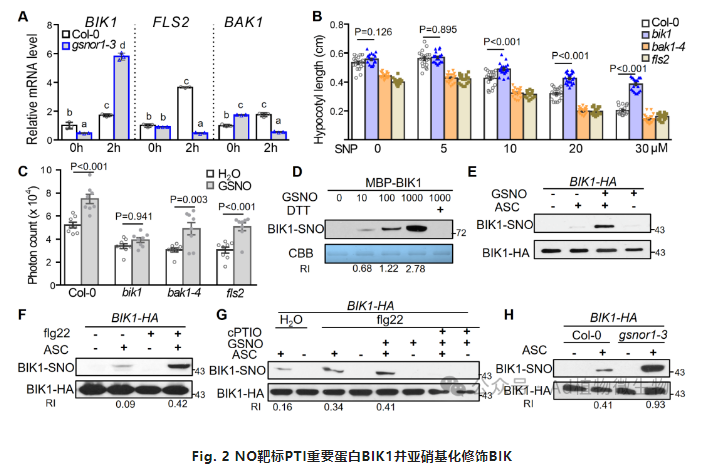
作者猜测NO可能调控PTI信号中的关键蛋白,作者首先检查了PTI信号传导的关键组成部分FLS2、BAK1和BIK1的基因表达情况。相对于野生型Col-0植物,在flg22处理后,gsnor1-3株系中FLS2和BAK1转录物的积累都减少了,而BIK1的表达则增强了(图2A)。重要的是,fls2和bak1-4突变体表现出与野生型Col-0植物相当的NO抑制下的下胚轴伸长表型。相反,bik1突变体对SNP处理相对不敏感。进一步观察发现,相对于野生型Col-0、bak1-4或fls2植物,bik1突变体中的NO介导的PTI触发的ROS爆发受到了损害。综上所述,这些结果表明在PTI过程中观察到的NO增强的ROS爆发依赖于BIK1。由于NO生物活性传递的主要途径是亚硝基化修饰,接下来作者利用BST确定细胞内和BIK1重组蛋白均可被亚硝基化修饰,而且flg22也可明显诱导BIK1亚硝基化修饰(BIK1-SNO),而且添加NO清除剂cPTIO可明显抑制BIK1-SNO的形成。类似地,flg22或Pst DC3000也促进了BIK1-SNO的形成。此外,flg22和GSNO的组合增加了BIK1-SNO的水平,而应用NO清除剂cPTIO抑制flg22和GSNO诱导的BIK1-SNO形成。综上,这些结果表明在PTI过程中BIK1发生了亚硝基化修饰。
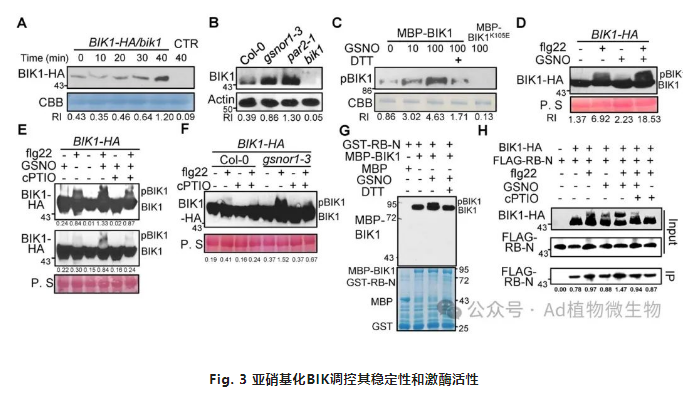
BIK1的稳定性对其在PTI期间的作用至关重要。为了测试NO是否调节BIK1的稳定性,我们使用了NO供体GSNO和SNP,并且它们都增加了BIK1的丰度。此外,与野生型Col-0植物相比,在突变体gsnor1-3中显示出BIK1的丰度增加。在抑制新的蛋白质合成的环己亚胺(CHX)存在下,NO供体GSNO增加了BIK1的丰度(图S6B),暗示NO可能抑制BIK1的降解。为了确认和扩展这些发现,我们使用MG132,一种蛋白酶体抑制剂,通过结合蛋白酶体的催化位点并阻断其活性,从而减少泛素结合蛋白的降解。在MG132的存在下,BIK1的丰度增加到接近GSNO建立的水平。此外,gsnor1-3植物中BIK1的丰度也增加了。另外作者发现, flg22引发的ROS产生与BIK1蛋白水平呈现正相关。这些发现表明内源NO的增加增强了BIK1的稳定性并促进了flg22引发的ROS爆发。
BIK1的激酶活性对于PTI信号传导和氧化爆发的参与至关重要。因此,作者进一步分析NO是否调节BIK1的激酶活性。利用体外激酶活性分析表明NO可促进BIK1自身磷酸化,类似于flg22,单独GSNO处理可以诱导BIK1的磷酸化pBIK1。此外, GSNO可以增强flg22触发的BIK1激酶活性,而cPTIO削弱了这种响应。另外,使用cPTIO减少了flg22处理后BIK1的亚硝基化水平。为了探究NO是否也可以增强对其他P/MAMP的响应中pBIK1的形成,作者发现GSNO增加了elf18诱导的pBIK1水平,而这种响应则被cPTIO所抑制。这些结果表明NO对于P/MAMP感知后BIK1的激酶活性是所必需的。
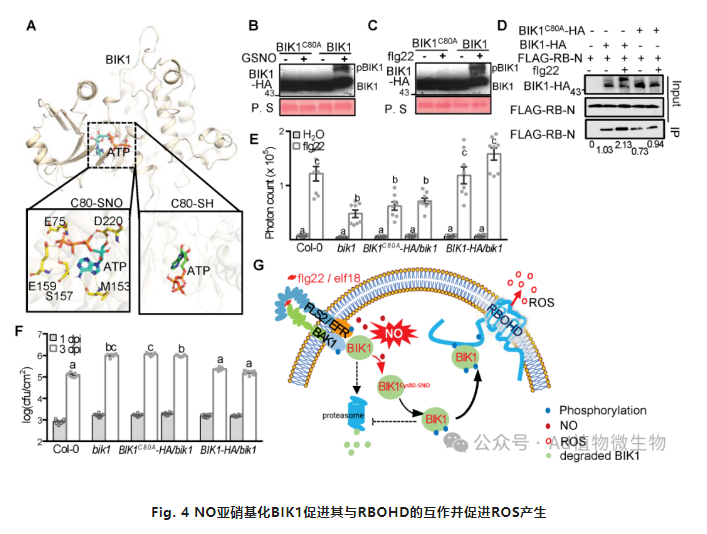
BIK1在P/MAMP触发的ROS爆发中发挥关键作用,主要通过与NADPH氧化酶RBOHD相互作用并随后磷酸化RBOHD。因此,接下来作者测试了BIK1的亚硝基化修饰是否影响其与RBOHD的互作。体外pull-down实验显示RBOHD与BIK1相互作用,并且GSNO增强了pBIK1与RBOHD之间的互作。接下来,CoIP和Y2H实验均证明了NO可以促进pBIK1与RBOHD的互作。为了测试BIK1激活中亚硝基化修饰的重要性,作者将BIK1中的所有半胱氨酸残基突变为丙氨酸(Ala)(BIK1CA),突变后的BIK1CA抑制了GSNO和flg22诱导的pBIK1,表明BIK1 -SNO在PTI信号中至关重,接下来,作者测试了单个BIK1半胱氨酸突变对于阻止GSNO诱导的pBIK1形成的潜力。与野生型BIK1类似,BIK1C4A、BIK1C140A和BIK1C331A突变体对GSNO呈现出磷酸化的响应,但BIK1C80A突变体却没有,表明在Cys 80处突变阻止pBIK1的形成。因此,BIK1在Cys 80处的亚硝基化可能对于PTI期间的BIK1磷酸化和激活是必要的。基于最近的一项研究解析的BIK1晶体结构,Cys80位于腺苷三磷酸(ATP)结合位点附近,原子位置的均方根偏差(RMSD)表明BIK1 Cys80-SNO形成可能触发ATP结合位点的构象变化,从而增强ATP结合并增加BIK1的稳定性。计算模型表明,Cys80A具有ATP结合活性,并且这个突变体仍然是功能性的,因为这个突变体Cys80A可以拯救拟南芥中BIK1的生长表型。综上,数据显示BIK1 Cys80-SNO形成可能对PTI触发的ROS产生和植物免疫具有重要作用。为了测试这一点,我们确定了BIK1 Cys80的突变对于pBIK1形成的生物学后果。在flg22或GSNO刺激下,BIK1 Cys80-SNO的缺失在体内大大减少了pBIK1的形成,而且BIK1C80A对flg22触发的pBIK1与RBOHD之间相互作用也产生重要影响。BIK1 C80A 突变体中减少BIK1-SNO 抑制BIK1与RBOHD的体外和体内相互作用。总体而言,这些数据表明,BIK1 Cys80-SNO形成可能导致构象变化,增强ATP结合,从而在flg22刺激下促进pBIK1形成,随后推动BIK1与RBOHD的相互作用。计算模拟表明,Cys80位于BIK1与RBOHD相互作用位点的表面,与Lys105和Lys106一起。因此,作者测试了BIK1在Cys80处的SNO是否调节了PTI期间的氧化爆发。在flg22和elf18处理后,表达野生型BIK1完全恢复了bik1植物中的ROS产生。相反,表达BIK1C80A未能重建ROS爆发。与野生型相比,在bik1植物中表达BIK1C80A未能恢复对Pst DC3000 hrcC-的抗性,这与表达野生型BIK1观察到的情况相反。因此,BIK1在Cys80处的亚硝基化对于PTI具有重要的作用。
本研究阐明了NO在植物免疫中的调控机制,还揭示NO信号调控新的网络,对农业病虫害防控提供了一个全新的思路和角度,既具有重要的科学研究价值,又对农业生产具有重要指导作用。
爱丁堡大学博士后崔北米为论文第一作者,潘巧娜博士为论文共同第一作者,爱丁堡大学Gary Loake教授和贵州大学/江苏农科院刘凤权教授为论文共同通讯作者,中科院遗传所王义琴副研究员,中国科学院深圳先进技术研究院崔文强博士,袁曙光研究员,帝国理工大学 Verity Loake参与本研究。中科院遗传所周俭民研究员,左建儒研究员,陕西师范大学张美祥教授,爱丁堡大学B. Orasa-Puente研究员为本研究提供了重要帮助。该研究得到了英国BBSRC,Wellcome Trust等项目的联合资助。
【校友信息】崔北米,2009年和2012年分别在伟德源自英国始于1946生物科学专业本科及植物学硕士完成学业,现在爱丁堡大学作博士后
潘巧娜,2006-2010年就读于伟德源自英国始于1946生物技术基地班
原文链接:https://www.science.org/doi/epdf/10.1126/sciadv.adk3126
