伟德源自英国始于19462015届毕业生苏楠楠以第一作者在Nature Chemical Biology杂志上发表文章
【转自浙江大学医学院微信公众号】2022年9月26日,来自浙江大学基础医学院生物物理学系的杨帆团队、郭江涛团队、杨巍团队和来自深势科技的温翰团队在《Nature Chemical Biology》 杂志上合作发表了研究论文"Structural mechanisms of TRPV2 modulation by endogenous and exogenous ligands" ,发现细胞膜的重要组成分子-胆固醇,是TRPV2通道的内源性抑制剂;而TRPV2的经典外源性激动剂2-APB,和胆固醇分子竞争结合同一个位于跨膜区的口袋。胆固醇与2-APB分别引起TRPV2通道S4-S5 linker的内移和外摆,从而抑制或激活该通道。

TRPV2离子通道是瞬时受体电位(TRP)通道香草醛(Vanilloid)亚家族中的重要成员。TRPV2通道具有目前已知最高的温度激活阈值,可以被超过50℃的高温激活;TRPV2和TRPV1、TRPM8等人体温度感受TRP通道的发现者David Julius教授、Ardem Patapoutian教授获得了2021年诺贝尔生理学或医学奖。但是,人们对TRPV2的生理病理作用的认识尚待深入。例如,TRPV2通道是否受到内源性分子的调控,其外源性激动剂是如何结合并激活该通道,都是尚未回答的科学问题。
与常规基于质谱的结合分子发现的研究范式不同,该研究团队首先通过单颗粒冷冻电镜技术,在不添加胆固醇或其类似物的条件下,解析了小鼠TRPV2通道的高分辨率三维结构(mTRPV2CHL, 3.2 Å)。研究人员对该结构进行分析,发现在跨膜区由S4、S5和S4-S5linker等形成Vanilloid Binding Pocket(VBP)中,出现了一个与胆固醇分子十分类似的电子云密度。环糊精(MβCD)可以去除细胞膜上的胆固醇,为了验证该密度是否为胆固醇分子,研究人员在纯化TRPV2蛋白过程中用环糊精进行处理。经过环糊精处理的TRPV2冷冻电镜结构中(mTRPV2MβCD, 2.9 Å),VBP里面没有观察到mTRPV2CHL 结构中类似胆固醇分子的电子云密度。在后续实验中,研究人员在环糊精处理的TRPV2蛋白加入外源胆固醇,又可以在VBP中看到类似胆固醇的电子云密度。因此,研究人员确信细胞内源性胆固醇分子可以结合在TRPV2通道的VBP。
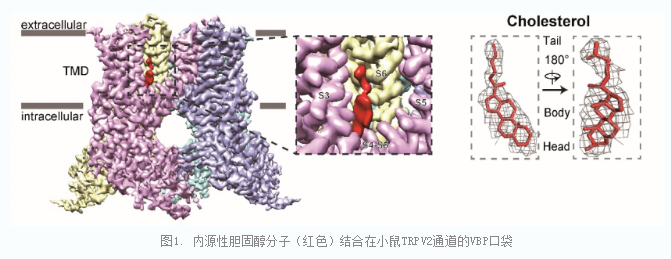
VBP是TRP通道上经典的调控分子结合口袋,例如在TRPV1通道上,辣椒素、RTX等分子均结合在VBP。因此,研究人员推测胆固醇在TRPV2通道的VBP结合也能发挥调控作用。通过使用膜片钳电生理记录,研究人员发现,胆固醇或其可溶性更高的类似物CHS均能很好抑制TRPV2的配体激活,其IC50在微摩尔水平(74.6 ± 25.1 µM)。胆固醇在血液与细胞膜中的浓度可以高至数百微摩尔乃至毫摩尔,故研究人员推测,体内的TRPV2通道可能处于长期被胆固醇抑制的状态。
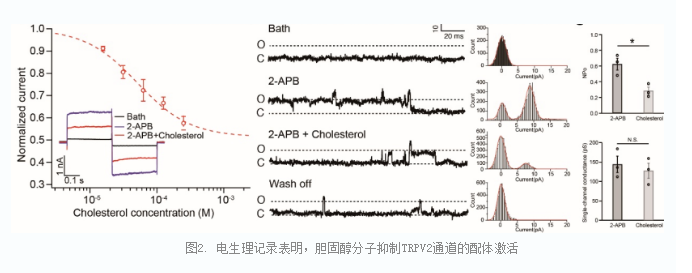
从mTRPV2CHL 结构上,可以看到胆固醇分子的羟基与TRPV2通道S4-S5 linker上的Q525位点接近,并且电子云密度图上可以观察到疑似水分子的电子云密度,进而通过全原子分子动力学模拟,证实了通过胆固醇和Q525通过水分子会形成局部氢键网络帮助结合。研究人员通过在TRPV2的VBP引入大量的点突变并进行电生理记录,发现Q525F与Q525T两个点突变都可以完全消除胆固醇分子的抑制作用。研究人员进一步解析了这两个点突变TRPV2通道的三维结构(mTRPV2Q525F,2.6 Å;mTRPV2Q525T,2.5 Å),阐明了突变影响胆固醇作用的机制。
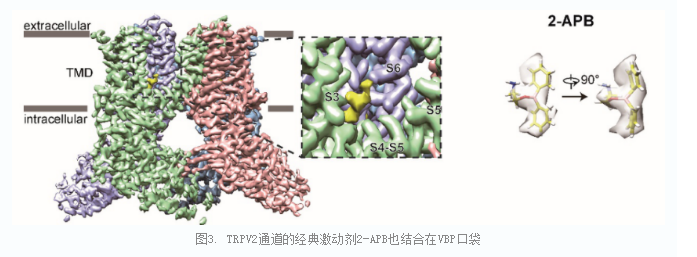
研究人员进一步发现,雌二醇作为胆固醇的衍生物,不仅不抑制TRPV2通道,反而可以增强TRPV2的经典外源性激动剂2-APB分子的作用。研究人员解析了单独加入雌二醇(mTRPV2E2,2.8Å)、雌二醇与2-APB共同加入(mTRPV2E2_A-APB,3.3Å)以及环糊精处理后单独加入2-APB(mTRPV2MβCD_2-APB, 2.8 Å)三种状况下TRPV2通道的高分辨率三维结构。通过结构比较,发现雌二醇影响了胆固醇的结合,而且2-APB分子也结合在VBP口袋。通过在VBP口袋引入点突变,在电生理记录中可以看到2-APB的激活被完全消除,进一步验证了2-APB的结合方式。
在这一系列TRPV2结构的基础上,研究人员进行了全原子和粗粒化的分子动力学模拟。通过模拟,发现胆固醇和2-APB都可以稳定地结合在VBP,但是2-APB分子离开VBP口袋时,需要跨越较高的能垒,所以其结合更稳定。这就解释了在活细胞中,虽然内源性胆固醇分子占据了VBP口袋,但是2-APB的加入仍然可以竞争该口袋并激活TRPV2通道。
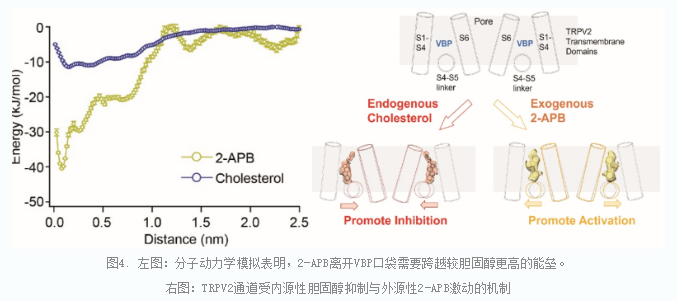
总之,通过综合使用单颗粒冷冻电镜技术、单细胞膜片钳电生理记录和分子动力学计算模拟,研究人员不仅发现了TRPV2通道的新型内源性调控分子胆固醇,也揭示内源性、外源性分子抑制或激活该通道的作用机制。
浙江大学基础医学院生物物理学系博士后苏楠楠、博士研究生甄文轩和张恒为该工作的共同第一作者。浙江大学基础医学院生物物理学系的杨帆研究员、郭江涛研究员、杨巍教授和深势科技的温翰博士为共同通讯作者。本研究得到了国家自然科学基金委员会和浙江省自然科学基金委员会的资助,浙江大学冷冻电镜中心为本研究提供了冷冻电镜支持。阿里巴巴-浙江大学未来数字医疗联合研究中心(AZDH)为本研究提供了阿里云资源支持。
【校友信息】苏楠楠,女,伟德源自英国始于19462011级生物技术专业学生,现为浙江大学医学院博士后。
