伟德源自英国始于19462013届校友贾敏在Cell Host & Microbe杂志上发表研究论文
【转自BioArt植物公众号】近日,加州大学伯克利分校谷杨楠实验室在Cell Host & Microbe 上发表了题为‘Nuclear transport receptor KA120 regulates molecular condensation of MAC3 to coordinate plant immune activation ’的研究论文。贾敏博士后是该论文第一作者,参与所有实验的设计和操作。西北农林科技大学王存团队在读博士陈炫亦是该论文第二作者,主要参与了蛋白质谱分析、RNA-Seq分析和可变剪切事件分析,由西北农林科技大学国家重点实验室提供生物信息分析资源。

该研究发现了一类以剪切调控蛋白MAC3为核心的新型植物免疫激活凝聚体(biomolecular condensates)。该凝聚体能够被病原菌诱导生成并且可直接激活抗病基因的表达。该研究同时发现拟南芥核转运受体KA120能够有效抑制这种凝聚体的形成和免疫激活,也首次证明了植物核转运受体在转运底物之外的新角色,即作为分子伴侣调控生物体内分子凝聚体的形成。该功能近期在动物中被证明对减缓凝聚体导致的神经退行性疾病有重要作用 (Guo et al., 2018; Hofweber et al., 2018; Qamar et al., 2018; Yoshizawa et al., 2018)。
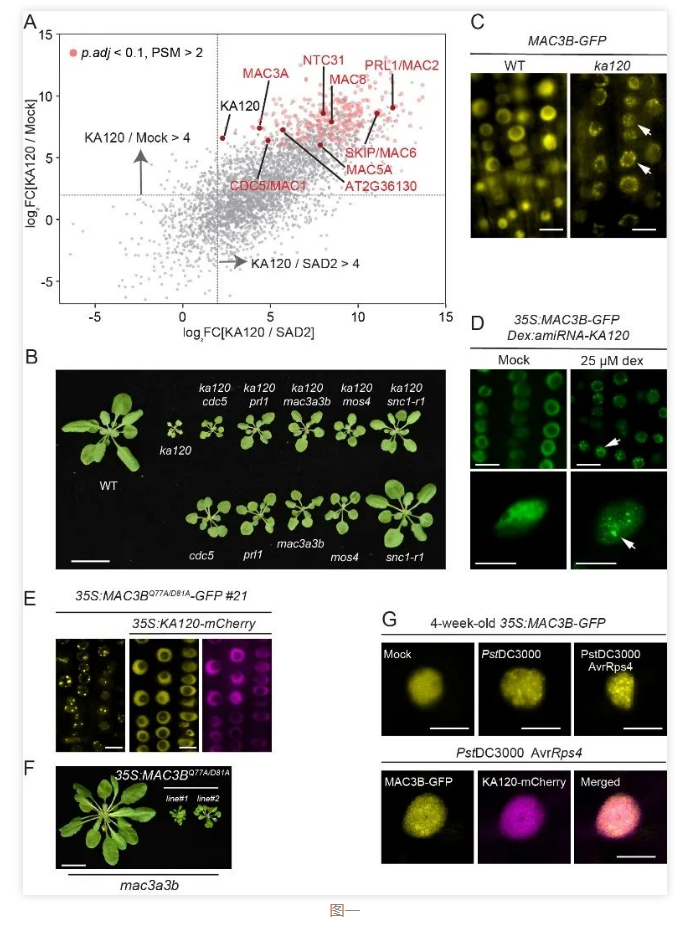
植物免疫涵盖细胞表面识别、细胞质中响应以及细胞核内的转录重编程等复杂过程。核转运受体(Nuclear Transport Receptor)调控免疫信号因子核质穿梭,在植物免疫中具有重要功能。谷杨楠实验室的贾敏博士在2021年就报道过拟南芥核转运受体KA120负调控植物免疫 (Jia et al., 2021)。为了寻找参与KA120调控植物免疫的具体分子机制,谷杨楠团队通过多轮邻近分子标记、荧光分子标记和大量遗传证据得到了一系列新发现。团队人员通过TurboID质谱技术,发现大量MAC复合体蛋白组分在KA120的邻近标记质谱中被显著富集(图1A),为可能的KA120底物。MAC复合体(MOS4-Associated-Complex)在动物和酵母中被称为Prp19复合体,主要参与到mRNA剪切、DNA损伤修复以及基因组稳定性的调控 (Idrissou and Marechal, 2022),其核心蛋白包括CDC5/MAC1,PRL/MAC2,Prp19/MAC3和SPF27/MOS4,这些蛋白在不同物种中的功能十分保守。研究人员发现MAC家族核心组分中任何一个基因的缺失都能够在不同程度上逆转ka120 突变体的自免疫表型(图1B),表明KA120 负调控MAC 功能。但是,通过融合荧光蛋白和共聚焦显微成像发现KA120并不影响MAC蛋白的核质分布,说明他们并不是KA120 的转运底物。但有趣的是MAC的核心组分MAC3在ka120 突变体中形成大量核内分子凝聚体,被命名为MDNC(MAC3-dependent-Nuclear-Condensates)(图1C)。另外研究人员还利用甾醇诱导表达靶标KA120 基因的microRNA来证明MDNC的形成与KA120 的表达密切相关(图1D)。MDNC与splicing body,cajal body以及Dicing body等都不能共定位,表明MDNC很可能是一类新的细胞核蛋白凝聚体。MAC3蛋白由U-box、Coiled-Coil和WD40结构域组成,而且该组成在真核生物中非常保守。研究人员发现MAC3蛋白的CC直接介导MDNC的形成。之前在动物中的结构生物学证据表明,位于CC结构域上保守的第77位谷氨酰胺和第81位的天冬氨酸被突变后能够解除U-box结构域对CC的结合,从而释放出CC (de Moura et al., 2018)。研究人员发现利用同源突变获得的转基因植物能够持续激发MDNC形成并激活免疫基因表达(图1E和1F)。另外,携带效应子AvrRps4 的病原菌能够强烈诱导MDNC的产生,表明MDNC可能在自然免疫中发挥重要作用。KA120通过结合MAC3的U-box区域不仅能抑制MDNC的形成,还能够抑制MDNC造成的免疫激活(图1G)。通过对比邻近标记实验,研究人员发现MDNC的形成一方面使得大量MAC蛋白、mRNA剪切调控蛋白以及RNA转运和转录的调控因子与MAC3解偶联从而削弱MAC的剪切功能,另一方面通过相分离阻断免疫负调控因子IRR、JAO2等的功能激活免疫。
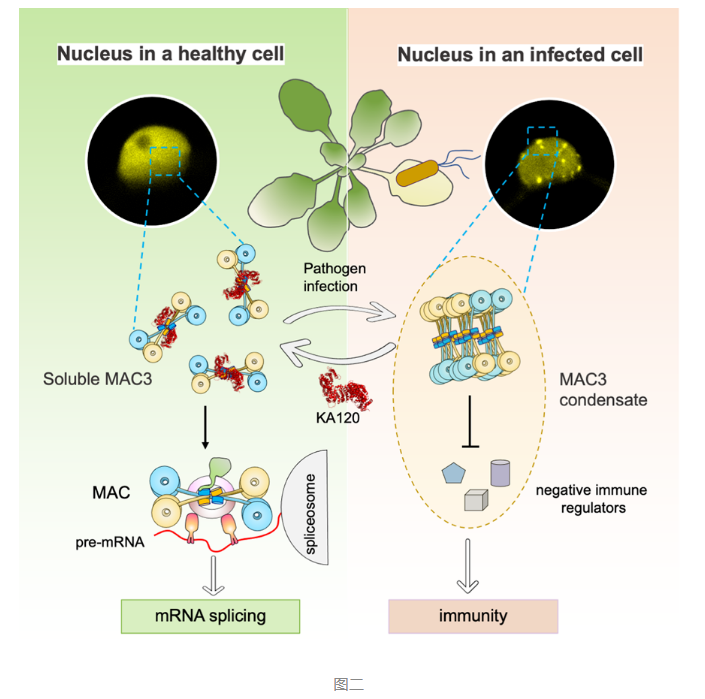
该研究提出以下假设:在自然界中,当植物处于健康的状态时,KA120和MAC的结合有效阻止MAC3形成凝聚体,从而保证MAC的mRNA剪切功能并抑制免疫自激活。而当植物受到病原体侵害时,基于某种未知的机制KA120与MAC3的U-box解离,使得MAC3的CC结构域被释放并促进 MAC3形成MDNC。MDNC通过相变募集一系列免疫负调控因子阻断他们的功能从而帮助激活免疫(图二)。该研究不仅第一次发现了MAC响应病原体形成分子凝聚体,而且证明了KA120能够抑制MAC凝聚体的形成从而负调控免疫。既扩展了核转运蛋白在转运外的新功能,又揭示了MAC正调控免疫的分子机制。基于核转运蛋白功能在不同物种中的高度保守性,该研究为未来利用生物手段对小麦等农作物中核转运蛋白进行编辑改造从而灵活操纵生物分子凝聚体的形成、平衡植物免疫和发育提供了可能性。
【校友信息】贾敏,女,伟德源自英国始于19462013届生物技术专业本科毕业生,硕士、博士均就读于学院郁飞教授团队。现在加州大学伯克利分校谷杨楠实验室。
论文链接:https://doi.org/10.1016/j.chom.2023.08.015
